中野研究室
がんリハビリテーションCANCER REHABILITATION
化学療法・放射線療法の影響
新規薬剤の開発や技術の進歩により多くのがん患者に適用されるようになり,特に造血器腫瘍に対して感度がよく,根治が望める治療法として良好な成績を収めています1).ただ,化学療法・放射線療法を実施する際には多種多様な副作用(表1)とそれに関連する有害事象が避けられません.優れた支持療法の開発により以前に比べると副作用の頻度や程度は改善されてきているものの,副作用が患者の活動を制限し,理学療法の進行を妨げ,運動機能や日常生活動作能力の低下を招いているケースが多く存在するのも事実です.加えて,近年の研究では,化学療法・放射線療法の副作用とがん患者の運動機能には深い関係があることが明らかにされつつあります2,3).化学療法・放射線療法を施行するがん患者に見られる運動機能障害は,四肢の筋力低下に起因するものがほとんどです.ただ,その筋力低下には,がん自体に由来による筋萎縮,身体活動量の低下による廃用性筋萎縮の他に,化学療法・放射線療法に伴う副作用の影響が混在している考えられます2,3).化学療法・放射線療法を施行するがん患者では,筋ボリュームと筋力が一致しないことが特徴の1つであり,その要因を多面的に分析して障害像を捉えていくことが重要となります.
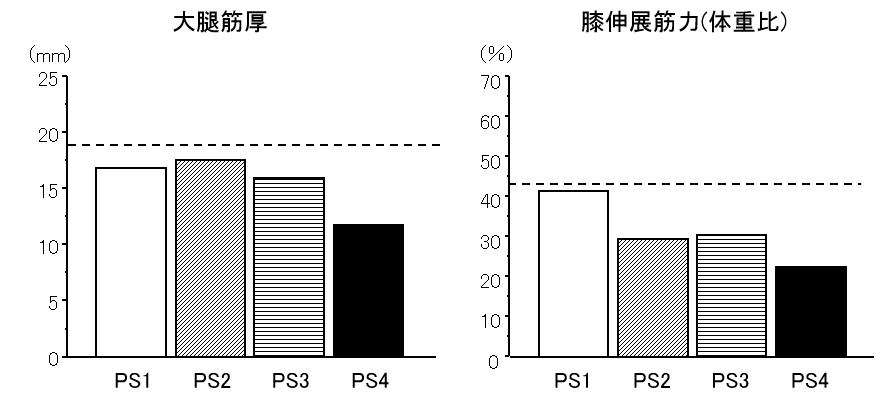
我々の調査によれば,全身状態の指標となるパフォーマンスステータス(ECOG Performance Status)で分類した結果では,PS=1,2,3の患者の間には大腿四頭筋厚の違いは認めていないにもかかわらず,膝伸展筋力はPS=1にくらべてPS=2,3の患者に低下が認められました.点線は同年齢層の地域高齢者の平均値を示します.(第50回日本理学療法学術大会,東京,平成27年5月)
がん患者の低栄養と悪液質
がん患者の多くには栄養障害にともなう体重減少を認めます.その本態は,がん自体に由来する食欲低下,疼痛などの経口摂取量の低下,消化管通過障害,下痢などの消化管機能障害による栄養摂取・消化吸収量の低下です.加えて,化学療法・放射線療法を施行するがん患者では,治療の副作用として悪心・嘔吐,食欲不振,口内炎や食道炎による嚥下障害,粘膜炎による消化管症状,味覚異常などが生じることがあり,それらの症状が栄養障害と体重減少を助長します.悪心・嘔吐はがん患者の40~70%と高頻度で起こる副作用であり4),それによって引き起こされる低栄養の状態が筋萎縮の進行を招く.また,がん患者のQOLは,20%が栄養摂取の状況,30%が体重減少の有無によって決定され,食欲不振を認めると死亡率が30%増加するともいわれています5).
がんのステージが進行したケースでは,栄養の摂取不良だけでは説明できない代謝異常を伴う治療抵抗性の栄養障害を認め,その状況を悪液質といいます.悪液質は慢性呼吸器疾患等にも認めるため,それと区別する意味でがんに関連するものをがん悪液質と呼ぶことがあります.悪液質の本態は未だ不明の部分が多いのですが,最近の研究では腫瘍が分泌する炎症性サイトカイン等が代謝異常を引き起こしていると考えられています6).悪液質が発生する頻度は,がんの種類によって異なり,胃がんや膵がんで高い.また,症状としては食欲低下,慢性炎症反応,筋組織;脂肪組織の異化の亢進,著しい体重減少,インスリン抵抗性など多岐にわたります7).悪液質が重度になると栄養治療を行ってもタンパク同化機構は働かず,体重や栄養指標の改善がみられない不可逆性になり,その状態を特に不応性悪液質といいます.この状態に一旦陥ると,栄養管理下で理学療法を行ったとしても,筋肥大を伴った筋力増強効果は得られなくなります.
低栄養と悪液質はそれぞれ単独で存在することは少なく,がんのステージが進行するにつれて両者の混在が顕著となり,がんの終末期では悪液質が優位となることが多いといいます.また,両者は互いに相乗的に作用し,がん患者の運動機能と予後に大きな影響を及ぼすと考えられています5).したがって,理学療法を行う際には,血液検査から栄養の指標となるアルブミン値,炎症マーカーのC反応性蛋白(C-reactive protein:CRP)5)を確認し,体重変化と照らし合わせ,栄養状態と悪液質の有無を評価す必要があります.

がん患者の身体症状・精神症状
疼痛
がんの終末期になると,患者の75%に疼痛が見られるといわれています15).WHOによるがん性疼痛の原因別分類では,①がん自体による痛み,②がんに関連した痛み(筋れん縮,リンパ浮腫,便秘,褥瘡など),③がんの治療による痛み(手術瘢痕の痛み,放射線照射部の痛み,化学療法による口内炎の痛み),④がんと無関係の痛み(変形性脊椎症,骨関節炎)などに分類されています15,16).がん性疼痛の機序別分類ではがん自体による痛みは,侵害受容性疼痛(nociceptive pain)と神経障害性疼痛(neuropathic pain)に分けられ,侵害受容性疼痛には骨や軟部組織や皮膚への侵害刺激によって起こる痛み,内臓の損傷や圧迫で生じる内臓痛が含まれます.化学療法の副作用として現れる侵害受容性の疼痛としては,薬物投与後に見られるインフルエンザ様症候群に伴う筋肉痛および関節痛があげられます1).一方,神経障害性疼痛は,末梢神経または中枢神経の損傷と圧迫によって生じる痛みで,痛みの起こり方は様々です.時には触る刺激や,普通では痛みとならない軽い刺激によって痛みが生じるアロデイニアを呈します.また,化学療法・放射線療法によって末梢神経障害が生じると,神経障害性疼痛を引き起こすこともあります15).
倦怠感
倦怠感は疲労感と脱力感を伴う全身衰弱と定義され,終末期のがん患者では「身の置き場がない」「どうしょうもなくだるい」などと表現されることが多く,がん患者の60~90%に認められるといわれています15).倦怠感の発生機序は十分に解明されていませんが,悪液質による代謝異常や,化学療法・放射線療法によって引き起こされる細胞死に伴う炎症性サイトカイン(IL-6やTNF-αなど)の放出などが原因といわれています17).特に化学療法・放射線療法の施行後は,数日後にわたって強い倦怠感が生じるため,一時的ではあるが理学療法の実施が困難な状況となります.また,倦怠感は他の身体症状や精神症状,治療による副作用などに随伴してしばしば出現します2).
貧血
多くのがん患者で見られる貧血は,出血,溶血,骨髄転移などの原因を除くと,化学療法・放射線療法と深い因果関係があるといわれています18).その出現頻度はがんの種類によって異なり,放射線療法よりも化学療法の方が生じやすいようです19).化学療法を施行してヘモグロビン値の低下,赤血球の減少が認められたとしても,貧血の症状を示さない患者が存在しますが,それは病態の進行が緩やかであるため身体が適応し,症状を感じなくなっているためと考えられています20).しかし,貧血の自覚症状がなくとも,貧血は筋力と筋持久力を低下させる要因になるため21),理学療法を行う際に貧血の有無を確認しておくこと必要があるでしょう.
不安・抑うつなどの精神症状
がん患者全体の約半数に何らかの精神症状を認め,がんの種類や部位との関わりは少ないといわれています22).その内容についてはいくつかの報告がなされていますが,Derogatis LRら23)の調査によれば,最も多いのは不安・抑うつ(適応障害)で患者の68%を占め,次いで多いのは大うつ病で13%,せん妄は数%と報告されています.精神症状は時期によっても異なり,がんの終末期になるとせん妄の頻度が最も多くなりますす22).ストレスから生じる精神症状は倦怠感と深い関係があり,その事実はシステマティックレビューのメタアナライシスでも確認されています25).また,精神症状には痛みや睡眠障害など他の身体症状が関係していることも示されています2).したがって,化学療法・放射線療法を施行するがん患者を評価する際には,身体症状と精神症状を引き離して考えることはできません.

がん患者に見られる身体症状・精神症状のランキング
がん患者に見られる精神症状の原因の多くは,がんに対する心理的反応,がんに伴う身体症状,化学療法・放射線療法に伴う副作用に対する苦痛・ストレスです.Carelle Nら24)の調査によると,がん患者が抱えるストレス度は男性の1位と女性の3位が倦怠感でした.(文献19より)
がん患者の運動機能
身体症状と精神症状は運動機能にも影響をおよぼすことが知られており,運動機能と倦怠感,不安・抑うつ,痛み,睡眠障害の間にはそれぞれ負の相関があります2).また,Brownら3)の報告によれば,倦怠感が弱いがん患者と強いがん患者で比較すると,筋量には差がないにも関わらず実際の筋力や運動機能は倦怠感が強い患者の方が低いことが示されています.これは,倦怠感が強いがん患者は筋量に相当する筋力や運動能力を発揮できていないことを意味しています.つまり,倦怠感が強いがん患者の中には筋力は弱くても筋量はある程度残されている者が含まれており,そのようなケースでは,倦怠感が改善されることにより筋力低下も改善する可能性があります.倦怠感と深い関係がある不安・抑うつなどの精神症状についても同じ事がいえます25).したがって,化学療法・放射線療法を施行するがん患者に理学療法においては,運動機能と身体症状・精神症状に加えて四肢周径や超音波,体組成計などで筋量を評価しておくと,障害像が捉えやすくなるでしょう.
がん患者の運動機能を考える際には,薬物療法の影響も考慮する必要があります.例えば,身体症状に対する薬物療法としてステロイド剤が使用される場合ありますが,ステロイド剤は骨格筋の異化を亢進させて速筋優位の筋萎縮を引き起こします26).これをステロイド筋症といい,がんに限らずステロイド剤の大量投与時にしばしば問題となります.現在のところ,診断基準や治療法は明らかにされておらず,悪液質や廃用性症候群による筋萎縮との区別はつきにくいでしょう.
化学療法・放射線療法を施行するがん患者では,身体症状・精神症状の増悪によって身体活動量が低下することが多く,それが廃用症候群の進行を招いて悪循環を形成し,日常生活活動(Activities of Daily Living:ADL)と生活の質(Quality of Life:QOL)の低下を深刻にします27,28).がん患者は高齢者の割合が多いことから,廃用症候群の進行には細心の注意が必要であります.一方,化学療法・放射線療法を施行するがん患者の中には身体機能は維持されているのにもかかわらず「動けない」,「動いてはいけない」と考えて自ら身体活動量を制限するケースが見られ,その悲観的な行動には自己効力感の低下が関与していると思われます29).運動機能が低下しているため自由に動けず身体活動量が低下している患者と,運動機能は維持されているが身体活動量は低下している患者を区別する必要があります.
がん患者に対するリハビリテーションの目標
がん患者の多くには筋萎縮を主体とする運動機能とADLの低下が認められるため,運動療法が適用されます.これはすべてのがん種類に共通する方針であり,ガイドラインでも強く推奨されています.また,化学療法・放射線療法に治療中・後であっても,血液検査値やバイタルサイン,その他の身体所見等に基づきリスク管理を行えば理学療法は安全に実施できると報告されています30).ただし,化学療法・放射線療法を施行するがん患者においては,倦怠感や痛み,不安・抑うつといった身体症状・精神症状に応じた理学療法プログラムを提供する必要があります.
リハビリテーションの適用と目標の参考を下図にまとめてみました.基本的な判断基準と目標は,廃用症候群の進行が予防できる運動量または身体活動量です).がんのステージ,年齢,がん以外の疾病,入院前の運動習慣,化学療法・放射線療法のスケジュールなどにも配慮する必要があります.また,介入初期から高い目標を設定するとモチベーションの低下や不安,ストレスを招く可能性があるため,目標は状況に応じて徐々に高めていくべきであり,特に行動変容アプローチにおいてはその点の配慮が重要となるでしょう.

(理学療法MOOK21がんの理学療法P114に掲載さされています)
がん患者に対する行動変容アプローチ
がん患者の中には,運動機能,身体症状,精神症状にさほど問題はなくても,臥床傾向が強く身体活動量が低下しているケースがあります.そのケースにおける身体活動量の低下の要因としては,①運動機能に対する自己評価が低く自分は動けないと思っていること,②活動することにより身体症状・精神症状が増悪すると考えていること,③治療中・後は安静が大事であり動いてはいけないと思っていること等があげられます.
そのような場合には,患者教育を中心とした行動変容アプローチが推奨されます.行動変容アプローチとは,学習理論や行動理論に基づいて患者の不適応行動を消去し,適応的な行動がとれるようにする心理療法から発展した治療法であり,行動療法とも呼ばれています.生活習慣病や慢性痛,精神疾患などで頻繁に用いられる認知行動療法も行動変容アプローチの治療体系に属します.具体的には,オリエンテーションによるガイドライン30)に基づいた運動療法の必要性と安全性の説明,目標設定,セルフモニタリング(日誌の作成),理学療法士とのフィードバック,自己管理の順に進めていきます.万歩計や加速度センサー活動量計を用いて日々の身体活動量を客観的に評価すると,運動を行っても身体症状が悪化しないこと,また身体症状が強くても運動できることを認知させ,効果的なフィードバックを行うことができるでしょう.
がん患者が増加し続けている今日,化学療法・放射線療法は外来治療へ移行しつつあります.これを受けて懸念されるのは,外来治療中のがん患者が在宅生活の中で廃用症候群を進行させ,本人のADL,QOLが低下するだけでなく,介護者にも大きな負担をかけることです.そうならないためには,入院中に適切な理学療法を実施して身体活動量とADL,QOLの向上を図り,運動の習慣化と自己管理を確立させてから外来治療へ移行するのが望ましいでしょう.それが化学療法・放射線療法を施行するがん患者に対する理学療法の最終的な目標になるでしょうか.
(中野治郎)
1)渡邊順一郎: 癌治療の理解. 化学療法. 辻 哲也, 他(編): 癌のリハビリテーション. 金原出版, pp17-26, 2006
2)Cheng KKF, et al: Impact of mood disturbance, sleep disturbance, fatigue and pain among patients receiving cancer therapy. Eur J Cancer Care 22: 70-78, 2013.
3)Brown DJ, et al: The correlation between fatigue, physical function, the systemic inflammatory response, and psychological distress in patients with advanced lung cancer. Cancer 103: 377-82, 2005
4)緩和医療ガイドライン作成委員会: 嘔気・嘔吐の病態生理: がん患者の消化器症状の緩和に関するガイドライン2011 年版. 金原出版, pp17, 2011.
5)濱口哲也, 他: がん患者の代謝と栄養. 日本静脈経腸栄養学会雑誌30: 911-916, 2015.
6)Fearon KC: The 2011 ESPEN Arvid Wretlind lecture: cancer cachexia: the potential impact of translational research on patient-focused outcomes. Clin Nutr 31: 577-582, 2012.
7)片山寛二: がん悪液質の病態と管理. 日本静脈経腸栄養学会雑誌30: 917-922, 2015.
9)勝山 壮, 他: がん化学療法に伴う末梢神経障害に関する実態調査. 日病薬誌42: 207-210, 2011.
10)Tofthagen C, eta l: Peripheral neuropathy caused by Paclitaxel and docetaxel: an evaluation and comparison of symptoms. J Adv Pract Oncol 4: 204-215, 2013.
11)Gilliam LA, et al: Targeted overexpression of mitochondrial catalase protects against cancer chemotherapy-induced skeletal muscle dysfunction. Am J Physiol Endocrinol Metab 311: E293-301, 2016.
12)Kim JP, et al: Quantitative analysis of myosin heavy chain expression change in laryngeal muscle after irradiation in rats. Yonsei Med J 52: 158-164, 2011.
13)Blomqvist L, et al: Evaluation of arm and shoulder mobility and strength after modified radical mastectomy and radiotherapy. Acta Oncol 43: 280-283, 2004.
14)van Leeuwen-Segarceanu EM, et al: Progressive muscle atrophy and weakness after treatment by mantle field radiotherapy in Hodgkin lymphoma survivors. Int J Radiat Oncol Biol Phys 82: 612-618, 2012.
15)倉木夏木: 終末期に現れうる身体症状. 薬局 60: 27-31, 2009.
16)武田文和(訳): 痛みの原因. がんの痛みからの解放WHO式がん疹痛治療法 第2版. 金原出版, pp69, 1987.
17)大西和子監(訳): 倦怠感. がん治療の副作用対策―化学療法・放射線療法の副作用対策. 照林社, pp109-111, 1998.
18)吉野一郎: 本邦におけるがん化学療法に伴う貧血の現状と問題点. 癌と化学療法41: 426-431, 2014.
19)Ludwig H, et al: The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 40: 2293-306, 2004.
20)上田泰典: 外来化学療法における副作用対策 骨髄抑制. コンセンサス癌治療 11: 208-211, 2012.
21)Penninx, BW, et al: Anemia is associated with disability and decreased physical performance and muscle strength in the elderly. J Am Geriatr Soc 52: 719-724, 2004.
Akechi T, et al: Major depression, adjustment disorders, and post-traumatic stress disorder in terminally ill cancer patients: associated and predictive factors. J Clin Oncol 22: 1957-65, 2004.
22)河瀬 雅紀: 緩和ケアにおける心理的側面-不安・抑うつへの対応・精神的ケア. バイオフィードバック研究35: 122-127, 2008.
23)Derogatis LR, et al: The prevalence of psychiatric disorders among cancer patients. JAMA 249: 751-757, 1983.
24)Carelle N, et al: Changing patient perceptions of the side effects of cancer chemotherapy. Cancer 95: 155-163, 2002.
25)Oh HS, et al: Systematic review and meta-analysis of the correlates of cancer-related fatigue. Worldviews Evid Based Nurs 8: 191-201, 2011.
26)田中廣壽, 他: 特殊・関連筋症の概念と治療 ステロイド筋症の分子機構. 医学のあゆみ 239: 114-119, 2011.
27)Ferriolli E, et al.: Physical activity monitoring: a responsive and meaningful patient-centered outcome for surgery, chemotherapy, or radiotherapy? J Pain Symptom Manage 43: 1025-1035, 2012.
28)石井 瞬: がん患者に対する理学療法の再考―身体活動量に着目したアプローチ―. 理学療法探求19: 2016(印刷中).
29)井上順一朗, 他: 造血幹細胞移植患者における身体活動量と運動セルフ・エフィカシーの関連性. 理学療法科学 29: 497-502, 2014.
30)Schmitz KH, Coumeya KS, et al.: American College of Sports Medicine
roundtable on exercise guidelines for cancer survivors. Med Sci Sports
Exerc 42: 1409-1426, 2010.
中野研究室
〒573-1010
大阪府枚方市新町二丁目5番1号
関西医科大学 リハビリテーション学部(設置準備室)
TEL 072-804-2173
nakanoj@hirakata.kmu.ac.jp